- A-
- A+
Aprokam

Folheto informativo: Informação para o utilizador
APROKAM 50 mg pó para solução injetável
Cefuroxima
Leia com atenção todo este folheto antes de começar a utilizar este medicamento, pois contém informação importante para si.
- Conserve este folheto. Pode ter necessidade de o ler novamente.
- Caso ainda tenha dúvidas, fale com o seu médico ou farmacêutico ou enfermeiro.
- Este medicamento foi receitado apenas para si. Não deve dá-lo a outros. O medicamento pode ser-lhes prejudicial mesmo que apresentem os mesmos sinais de doença.
- Se tiver quaisquer efeitos secundários, incluindo possíveis efeitos secundários não indicados neste folheto, fale com o seu médico ou farmacêutico ou enfermeiro. Ver secção 4.
O que contém este folheto:
1. O que é APROKAM e para que é utilizado
2. O que precisa de saber antes de lhe ser administrado APROKAM
3. Como é administrado APROKAM
4. Efeitos secundários possíveis
5. Como conservar APROKAM
6. Conteúdo da embalagem e outras informações
1. O que é APROKAM e para que é utilizado
• APROKAM contém uma substância ativa, cefuroxima (sob a forma de cefuroxima sódica), que pertence a um grupo de antibióticos chamados cefalosporinas. Os antibióticos são usados para matar as bactérias ou “germes” que causam infeções.
• Este medicamento será utilizado se for submetido a uma cirurgia aos olhos por ter cataratas (enevoamento do cristalino).
• O seu cirurgião oftalmológico administrará este medicamento através de uma injeção no olho no final da cirurgia da catarata para prevenir uma infeção no olho.
2. O que precisa de saber antes de lhe ser administrado APROKAM
Não utilize APROKAM:
- se tem alergia (hipersensibilidade) à cefuroxima ou a qualquer outro antibiótico do tipo das cefalosporinas.
Advertências e precauções
Fale com o seu médico ou farmacêutico ou enfermeiro antes de utilizar APROKAM:
• se é alérgico a outros antibióticos como a penicilina,
• se está em risco de contrair uma infeção devido a uma bactéria chamada Staphylococcus aureus resistente à meticilina,
• se está em risco de contrair uma infeção grave,
• se lhe foi diagnosticada uma catarata complicada,
• se está planeada uma cirurgia ocular combinada,
• se tem uma doença grave da tiroide.
APROKAM é apenas administrado através de uma injeção no olho (injeção intracameral).
APROKAM deve ser administrado nas condições de assepsia (o que significa em condições de higiene e isentas de germes) da cirurgia da catarata.
Um frasco para injetáveis de APROKAM deve ser usado apenas para um doente.
Outros medicamentos e APROKAM
Informe o seu médico ou farmacêutico se estiver a tomar, tiver tomado recentemente ou se vier a tomar outros medicamentos.
Gravidez e amamentação
• Se está grávida ou a amamentar, se pensa estar grávida ou planeia engravidar, consulte o seu médico ou farmacêutico antes de lhe ser administrado este medicamento.
• APROKAM ser-lhe-á apenas administrado se os benefícios compensarem os possíveis riscos.
APROKAM contém sódio
Este medicamento contém menos do que 1 mmol (23 mg) de sódio por dose ou seja, é praticamente “isento de sódio”.
3. Como é administrado APROKAM
• As injeções de APROKAM serão administradas por um cirurgião oftalmológico no final da cirurgia da catarata.
• APROKAM é fornecido sob a forma de um pó estéril que, antes de ser administrado, é dissolvido numa solução de soro fisiológico para injetáveis.
Se lhe for administrado menos ou mais APROKAM do que deveria
A sua medicação ser-lhe-á geralmente administrada por um profissional de saúde. Se pensa que se podem ter esquecido de lhe administrar uma dose ou que recebeu uma dose do medicamento superior à que deveria, por favor informe o seu médico ou enfermeiro.
Caso ainda tenha dúvidas sobre a utilização deste medicamento, fale com o seu médico ou farmacêutico ou enfermeiro.
4. Efeitos secundários possíveis
Como todos os medicamentos, este medicamento pode causar efeitos secundários, embora estes não se manifestem em todas as pessoas.
O seguinte efeito secundário é muito raro (pode afetar até 1 em 10.000 pessoas):
• Reação alérgica grave que provoca dificuldade em respirar ou tonturas.
O seguinte efeito secundário é reportado com uma frequência “Desconhecida” (não pode ser calculada a partir dos dados disponíveis):
• Edema macular (visão turva ou distorcida na proximidade ou no centro do seu campo de visão).
Comunicação de efeitos secundários
Se tiver quaisquer efeitos secundários, incluindo possíveis efeitos secundários não indicados neste folheto, fale com o seu médico, farmacêutico ou enfermeiro. Também poderá comunicar efeitos secundários diretamente ao INFARMED, I.P. através dos contactos abaixo. Ao comunicar efeitos secundários, estará a ajudar a fornecer mais informações sobre a segurança deste medicamento.
INFARMED, I.P.
Direção de Gestão do Risco de Medicamentos
Parque da Saúde de Lisboa, Av. Brasil 53
1749-004 Lisboa
Tel: +351 21 798 73 73
Linha do Medicamento: 800222444 (gratuita)
Sítio da internet: http://www.infarmed.pt/web/infarmed/submissaoram
E-mail: farmacovigilancia@infarmed.pt
5. Como conservar APROKAM
Manter este medicamento fora da vista e do alcance das crianças.
Não utilize APROKAM após o prazo de validade impresso no rótulo do frasco para injetáveis e na embalagem exterior após EXP. O prazo de validade corresponde ao último dia do mês indicado.
Conservar abaixo de 25ºC. Manter o frasco para injetáveis na embalagem exterior para proteger da luz.
Apenas para uma única utilização.
Após reconstituição: o produto deve ser usado imediatamente.
Não deite fora quaisquer medicamentos na canalização ou no lixo doméstico. Pergunte ao seu farmacêutico como deitar fora os medicamentos que já não utiliza. Estas medidas ajudarão a proteger o ambiente.
6. Conteúdo da embalagem e outras informações
Qual a composição de APROKAM
- A substância ativa é a cefuroxima (sob a forma de cefuroxima sódica).
- Cada frasco para injetáveis contém 50 mg de cefuroxima.
- Após reconstituição, 0,1 ml de solução contêm 1 mg de cefuroxima.
- Não contém outros componentes.
Qual o aspeto de APROKAM e conteúdo da embalagem
APROKAM é um pó para solução injetável branco ou esbranquiçado, fornecido num frasco para injetáveis de vidro.
Cada embalagem contém um ou dez ou vinte frascos para injetáveis ou 10 frascos para injetáveis com 10 agulhas estéreis com filtro. É possível que não sejam comercializadas todas as apresentações.
Titular da Autorização de Introdução no Mercado e Fabricante
Titular da Autorização de Introdução no Mercado
LABORATOIRES THEA
12 Rue Louis Blériot
63017 CLERMONT-FERRAND Cedex 2
França
Fabricante
BIOPHARMA S.R.L.
Via Delle Gerbere, 22/30 (loc. S. PALOMBA)
00134 ROMA (RM)
Itália
ou
LABORATOIRES THEA
12 Rue Louis Blériot
63017 CLERMONT-FERRAND Cedex 2
França
Este medicamento encontra-se autorizado nos seguintes Estados Membros do Espaço Económico Europeu (EEE) sob as seguintes denominações:
Alemanha, Áustria, Bélgica, Bulgária, Dinamarca, Eslováquia, Eslovénia, Finlândia, França, Holanda, Itália, Islândia, Luxemburgo, Noruega, Polónia, Portugal, República Checa, Roménia, Suécia, Reino Unido: APROKAM
Chipre, Grécia, Espanha: PROKAM
Irlanda: APROK
Este folheto foi revisto pela última vez em 08/2019
A informação que se segue destina-se apenas aos profissionais de saúde:
Incompatibilidades
Não se encontra descrita na literatura qualquer incompatibilidade com os produtos mais frequentemente utilizados na cirurgia da catarata. Este medicamento não deve ser misturado com outros medicamentos, exceto os que se encontram mencionados em seguida [solução injetável de cloreto de sódio a 9 mg/ml (0,9%)].
Como preparar e administrar APROKAM
Frasco para injetáveis para uma única utilização apenas para administração intracameral.
APROKAM deve ser administrado após reconstituição através de uma injeção intraocular na câmara anterior do olho (injeção intracameral) efetuada por um cirurgião oftalmológico, nas condições de assepsia recomendadas para a cirurgia da catarata.
A solução reconstituída deve ser visualmente inspecionada e só deverá ser utilizada se a solução for incolor ou ligeiramente amarelada e isenta de partículas visíveis.
O produto deve ser usado imediatamente após a reconstituição e não deve ser reutilizado.
A dose recomendada para a cefuroxima é de 1 mg em 0,1 ml de solução injetável de cloreto de sódio a 9 mg/ml (0,9%).
NÃO INJETE UMA DOSE SUPERIOR À RECOMENDADA.
O frasco para injetáveis destina-se apenas a uma única utilização.
Um frasco para injetáveis apenas para um doente. Cole a etiqueta destacável do frasco para injetáveis na ficha do doente.
Siga as seguintes instruções para preparar o APROKAM para administração intracameral:
1. Verifique a integridade da cápsula de abertura fácil antes de a retirar.
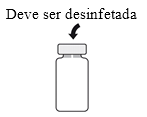
2. Desinfete a superfície da tampa de borracha antes de efetuar o passo 3.
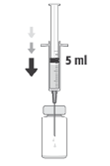
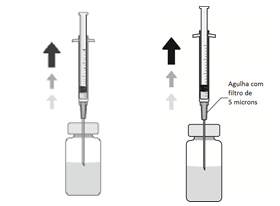
3. Insira a agulha na vertical no centro da tampa do frasco para injetáveis, mantendo o frasco para injetáveis na posição vertical. Em seguida, usando uma técnica asséptica injete no frasco para injetáveis 5 ml de uma solução injetável de cloreto de sódio a 9 mg/ml (0,9%).
4. Agite suavemente até que a solução esteja isenta de partículas visíveis.
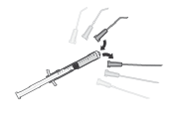
5. Adapte uma agulha estéril (18G x 1½”, 1,2 mm x 40 mm) com um filtro de 5 microns (membrana de copolímero acrílico num suporte de nylon não tecido) numa seringa estéril de 1 ml (a agulha estéril com um filtro de 5 microns poderá ser fornecida na embalagem). Empurre esta seringa verticalmente no centro da tampa do frasco para injetáveis, mantendo o frasco para injetáveis na posição vertical.
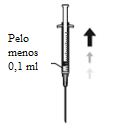
6. Aspire assepticamente, pelo menos 0,1 ml de solução.
7. Retire a agulha da seringa e adapte na seringa uma cânula apropriada para a câmara anterior.
8. Cuidadosamente deve expelir o ar da seringa e ajustar a dose para atingir a marca correspondente a 0,1 ml na seringa. A seringa encontra-se preparada para a injeção.
Após a utilização, rejeite a solução reconstituída que ainda restar. Não a guarde para uma utilização subsequente.
Qualquer medicamento não utilizado ou resíduos devem ser eliminados de acordo com as exigências locais. Elimine as agulhas utilizadas nos contentores adequados.