- A-
- A+
Mydriasert

Folheto informativo: Informações para o utilizador
MYDRIASERT 5.4 mg + 0.28 mg Inserto oftálmico
Cloridrato de fenilefrina + tropicamida
Leia com atenção todo este folheto antes de começar a utilizar este medicamento, pois contém informação importante para si.
- Conserve este folheto. Pode ter necessidade de o ler novamente.
- Caso ainda tenha dúvidas, fale com o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi receitado apenas para si. Não deve dá-lo a outros. O medicamento pode ser-lhes prejudicial mesmo que apresentem os mesmos sinais de doença.
- Se tiver quaisquer efeitos indesejáveis, incluindo possíveis efeitos indesejáveis não indicados neste folheto, fale com o seu médico, farmacêutico ou enfermeiro. Ver secção 4.
O que contém este folheto:
1. O que é MYDRIASERT e para que é utilizado
2. O que precisa de saber antes de utilizar MYDRIASERT
3. Como utilizar MYDRIASERT
4. Efeitos indesejáveis possíveis
5. Como conservar MYDRIASERT
6. Conteúdo da embalagem e outras informações
1. O que é MYDRIASERT e para que é utilizado
MYDRIASERT é um medicamento oftálmico, isto é, exclusivamente para tratamento ocular.
A utilização de MYDRIASERT é destinada apenas a profissionais de saúde.
MYDRIASERT destina-se a ser inserido pelo pessoal médico na pálpebra inferior do seu olho. Utiliza-se para obter uma midríase (dilatação da pupila), antes de uma intervenção cirúrgica ou para fins de diagnóstico.
2. O que precisa de saber antes de utilizar MYDRIASERT
NÃO UTILIZE MYDRIASERT nos seguintes casos:
- Se tem alergia à tropicamida ou ao cloridrato de fenilefrina ou a qualquer outro componente deste medicamente (indicados na secção 6). - Em doentes com glaucoma de ângulo fechado ou em risco de precipitação de glaucoma (aumento da pressão ocular).
- Em crianças com idade inferior a 12 anos.
Advertências e precauções
- Uma vez que este medicamento causa perturbações visuais prolongadas, tenha o cuidado de vir acompanhado à consulta (ver efeitos indesejáveis possíveis).
- Em caso de desconforto após inserção do inserto, informe o seu médico: pode ocorrer uma deslocação ou, mais raramente, a perda do inserto.
- Se sofre de grave secura dos olhos, o médico poderá ter de colocar uma gota de solução salina no olho para reduzir o risco de irritação ocular.
- Em caso de hipertensão (pressão arterial elevada), aterosclerose (espessamento da parede arterial), doença cardíaca ou hipertiroidismo (aumento da atividade da glândula tiroide) ou perturbações prostáticas, informe o seu médico.
- Em determinadas pessoas com predisposição, os agentes midriáticos (produtos que dilatam a pupila) podem desencadear uma crise de glaucoma agudo (devido ao súbito aumento da pressão ocular).
- É desaconselhado o uso de lentes de contacto hidrófilas durante o tratamento.
Crianças e adolescentes
Mydriasert não deve ser utilizado em crianças com idade inferior a 12 anos, uma vez que as crianças parecem ser mais sensíveis ao risco de efeitos indesejáveis graves. Não se recomenda a utilização de Mydriasert em crianças com idades entre os 12 e os 18 anos pois não existe experiência clínica adequada.
Outros medicamentos e MYDRIASERT
Informe o seu médico se estiver a usar medicamentos que dilatem as pupilas (midríase), para além de Mydriasert, de forma que o médico possa determinar a quantidade total de agente midriático à qual ficará exposto.
Informe o seu médico ou farmacêutico se estiver a tomar, tiver tomado recentemente ou se vier a tomar outros medicamentos, incluindo medicamentos obtidos sem receita médica. Embora Mydriasert seja aplicado localmente, estas informações são importantes, uma vez que alguns medicamentos podem afetar a ação de outros.
Gravidez e aleitamento
Não existem dados adequados sobre a utilização de Mydriasert ou das suas substâncias ativas em mulheres grávidas. Por isso, Mydriasert não deverá ser utilizado durante a gravidez, a menos que seja claramente necessário.
A utilização durante o aleitamento não é recomendada.
Condução de veículos e utilização de máquinas
Não conduza ou utilize máquinas porque MYDRIASERT pode causar perturbações visuais incómodas por algumas horas (turvação devido à dilatação prolongada da pupila).
Informações importantes sobre alguns componentes de MYDRIASERT
Os desportistas devem ser alertados para o facto de este medicamento conter uma substância ativa (o cloridrato de fenilefrina) que pode originar resultados positivos nos testes para deteção de substâncias proibidas.
3. Como utilizar MYDRIASERT
DESTINADO APENAS A UTILIZAÇÃO POR PROFISSIONAIS DE SAÚDE.
Mydriasert destina-se a ser usado em adultos. Mydriasert não deve ser ingerido.
O profissional de saúde colocará um inserto oftálmico dentro da pálpebra inferior do olho em questão. O profissional retirará o inserto em 30 minutos, quando a pupila se apresentar suficientemente dilatada, e antes de proceder à operação ou à investigação do olho. O inserto oftálmico não deve permanecer dentro do olho por mais de 2 horas.
Se utilizar mais MYDRIASERT do que deveria
Dado que um único inserto será inserido no olho pelo médico ou profissional de saúde, é improvável o risco de utilizar mais Mydriasert do que o recomendado. No entanto, se o profissional de saúde precisar de usar gotas oculares midriáticas, para além de Mydriasert, pode ocorrer o risco de sobredosagem das substâncias ativas de Mydriasert.
Os sintomas de sobredosagem das substâncias ativas de Mydriasert podem incluir fadiga extrema, sudação, tonturas, diminuição do ritmo cardíaco, coma, dores de cabeça, aumento do ritmo cardíaco, boca e pele seca, sonolência invulgar, rubor e dilatação prolongada das pupilas.
Caso ainda tenha dúvidas sobre a utilização deste medicamento, fale com o seu médico ou farmacêutico.
4. Efeitos secundários possíveis
Como todos os medicamentos, este medicamento pode causar efeitos secundários, embora estes não se manifestem em todas as pessoas.
Frequentes: podem afetar até 1 em 10 pessoas:
- picadas,
- visão enevoada,
- desconforto visual devido à perceção da presença ou deslocação do inserto oftálmico.
Pouco frequentes: podem afetar até 1 em 100 pessoas:
- lacrimejo,
- irritação,
- encadeamento devido à dilatação prolongada da pupila,
- queratite ponteada superficial (inflamação da córnea).
Raros: podem afetar até 1 em 1.000 pessoas:
- reações alérgicas: inflamação das pálpebras (blefarite), inflamação da conjuntiva (conjuntivite).
Muito raros: podem afetar até 1 em 10.000 pessoas:
- convulsões.
Foram observadas úlceras da córnea (pequenas erosões da superfície do olho) e edema da córnea (inflamação da superfície do olho) quando o inserto oftálmico foi acidentalmente deixado dentro do olho.
Em indivíduos com predisposição, MYDRIASERT pode desencadear uma crise de glaucoma agudo (súbito aumento da pressão intraocular):em caso de sintomas anormais após a administração (vermelhidão, dor e perturbações visuais), contacte imediatamente o seu médico.
Embora improvável após administração no olho, as substâncias ativas contidas em MYDRIASERT podem causar os seguintes efeitos secundários, que deverão ser tidos em consideração:
- aumento da pressão arterial, taquicardia,
- muito raramente, incidentes mais graves, como arritmia cardíaca,
- tremores, palidez, dores de cabeça, boca seca.
Efeitos indesejáveis adicionais em crianças
Frequência desconhecida (não pode ser calculada a partir dos dados disponíveis)
- Fluido ou inchaço nos pulmões
- Palidez em redor dos olhos em bebés prematuros
Comunicação de efeitos indesejáveis
Se tiver quaisquer efeitos indesejáveis, incluindo possíveis efeitos indesejáveis não indicados neste folheto, fale com o seu médico, farmacêutico ou enfermeiro. Também poderá comunicar efeitos secundários diretamente ao INFARMED, I.P. através dos contactos abaixo. Ao comunicar efeitos secundários, estará a ajudar a fornecer mais informações sobre a segurança deste medicamento.
INFARMED, I.P.
Direção de Gestão do Risco de Medicamentos
Parque da Saúde de Lisboa, Av. Brasil 53
1749-004 Lisboa
Tel: +351 21 798 73 73
Linha do Medicamento: 800222444 (gratuita)
Sítio da internet: http://www.infarmed.pt/web/infarmed/submissaoram
E-mail: farmacovigilancia@infarmed.pt
5. Como conservar MYDRIASERT
Manter este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após o prazo de validade impresso na saqueta após "VAL".
Não conservar acima de 25°C.
Usar imediatamente após abertura da saqueta.
Não utilizar MYDRIASERT se observar qualquer deterioração no invólucro da saqueta ou no inserto oftálmico.
6. Conteúdo da embalagem e outras informações
Qual a composição de MYDRIASERT
- As substâncias ativas são tropicamida 0.28 mg e cloridrato de fenilefrina 5.4 mg, em cada inserto oftálmico.
- Os outros componentes são o metacrilato de amónio copolímero tipo A, Eudragit NE 30 D, dibehenato de glicerilo e etilcelulose.
Qual o aspeto de MYDRIASERT e conteúdo da embalagem
MYDRIASERT é fornecido numa saqueta.
MYDRIASERT tem o formato de uma pequena placa (inserto) branca, oblonga (4.3 mm x 2.3 mm).
Cada embalagem contém outra saqueta com uma pinça esterilizada descartável, usada para colocação de MYDRIASERT no olho.
Embalagens de 1 inserto e 1 pinça, 10 insertos e 10 pinças, 20 insertos e 20 pinças, 50 insertos e 50 pinças ou 100 insertos e 100 pinças.
É possível que não sejam comercializadas todas as apresentações.
Titular da Autorização de Introdução no Mercado e Fabricante
Titular da Autorização de Introdução no Mercado
Laboratoires Théa
12, Rue Louis Blériot - Zone Industrielle du Brézet
63017 CLERMONT-FERRAND – FRANÇA
Fabricante:
BENAC
10, Avenue Paul Langevin
17180 PÉRIGNY – FRANÇA
Este medicamento encontra-se autorizado nos Estados Membros do Espaço Económico Europeu (EEE) sob as seguintes denominações:
| Alemanha | Mydriasert |
| Áustria | Mydriasert |
| Bélgica | Mydriasert |
| Dinamarca | Mydriasert |
| Espanha | Mydriasert |
| Finlândia | Mydriasert |
| França | Mydriasert |
| Holanda | Mydriasert |
| Itália | Mydriasert |
| Luxemburgo | Mydriasert |
| Portugal | Mydriasert |
|
Reino Unido
|
Mydriasert |
| Suécia | Mydriasert |
Este folheto informativo foi revisto pela última vez em 11/2021
_______________________________________________________________
A informação que se segue destina-se apenas aos médicos e aos profissionais dos cuidados de saúde.
Não ingerir.
Antes de usar o medicamento, verifique a integridade da saqueta. Em caso de deterioração do invólucro da saqueta, a esterilidade deixa de estar assegurada; neste caso, use outro inserto oftálmico retirado de uma embalagem intacta.
POSOLOGIA
O profissional de saúde coloca um inserto oftálmico no saco conjuntival inferior do olho em questão, num máximo de duas horas antes da intervenção cirúrgica ou da investigação.
População pediátrica
Mydriasert está contraindicado em crianças com idade inferior a 12 anos.
Não existem dados quanto à utilização em crianças com idades entre os 12 e os 18 anos, pelo que Mydriasert não é recomendado para estes doentes.
MODO DE ADMINISTRAÇÃO
Cortar o bordo do invólucro ao longo da linha ponteada, abrir a saqueta e localizar o inserto. Puxar para baixo a pálpebra inferior, segurando-a entre o polegar e o indicador (A) e aplicar o inserto oftálmico no saco conjuntival inferior, usando a pinça esterilizada descartável fornecida na embalagem, a qual deve ser eliminada imediatamente após a utilização (B).
INSTRUÇÕES DE UTILIZAÇÃO
O inserto oftálmico não deve ser deixado mais de duas horas dentro do saco conjuntival inferior. O médico pode retirar o inserto oftálmico logo que a midríase seja considerada suficiente para a intervenção ou o procedimento a realizar; no máximo, o inserto deve ser retirado 30 minutos após dilatação suficiente da pupila. Em caso de desconforto, verificar se o inserto foi corretamente inserido na base do saco conjuntival inferior.
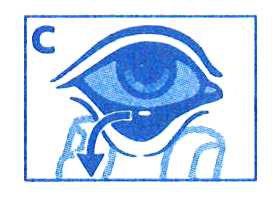
ADVERTÊNCIA: RETIRADA DO INSERTO OFTÁLMICO
Antes de uma intervenção ou procedimento, e logo que se obtenha a midríase desejada, o inserto oftálmico deve ser retirado do saco conjuntival inferior usando uma pinça cirúrgica esterilizada ou uma mecha esterilizada ou uma solução de lavagem ou irrigação esterilizada, puxando para baixo a pálpebra inferior (C).